原标题:体外试剂盒IVDD和IVDR认证是什么?认证流程怎么样?哪里可以办理?
2017年5月25日体外诊断医疗器械法规(In Vitro Diagnostic Regulation, IVDR)正式生效,并于2022年5月26日起实施。自实施之日起,IVDR将取代原体外诊断设备指令(IVDD)。在欧盟地区范围内,医疗器械制造商一定要按照欧盟MDR以及IVDR的规定对产品、文件和生产流程做调整,才能在欧洲经济区(EEA)发售。
今年10月,欧盟颁布了医疗器械新法规IVDR延期的草案,该草案修正了该过渡期,数量众多的低风险等级器械将会有更长的过渡期,并且,由发证机构介入发证的IVD产品的过渡期将会延长到2025年5月26日。
由于医疗资源被转移用于同时应对新型冠状病毒肺炎疫情以及IVDR引入的重大变化,成员国当局、医疗机构、公告机构和经济运营商无法在2022 年 5 月 26 日前完全满足IVDR的实施要求。
尤其是迄今为止,根据IVDR仅指定了六家公告机构,公告机构审核资源严重不足,导致制造商难以及时进行法律规定的合格评定程序。由于目前指定的公告机构仅在三个国家(德国、法国和荷兰)设立,因此,对于在其他成员国设立的中小企业(SMEs)来说,面临更加大的困难,它们倾向于向自己或邻近成员国的公告机构提出申请。
如果不加以解决,这样的一种情况有几率会使市场上为医疗机构和公众提供的大量体外诊断医疗器械的供应出现严重中断。
IVDR第110条规定,在2022年5月26日之前,持有公告机构依据IVDD颁发的证书的体外诊断医疗器械的过渡期至2024年5月26日。这一过渡期将延长1年,至2025年5月。然而,只有在该指令下(约8%)获得公告机构证书的医疗器械才会从现有的过渡条款中受益。
更新后的IVDR将所有体外诊断设备从低到高分成A、B、C、D四类,该分类规则来源于全球协调工作组(GHTF)。
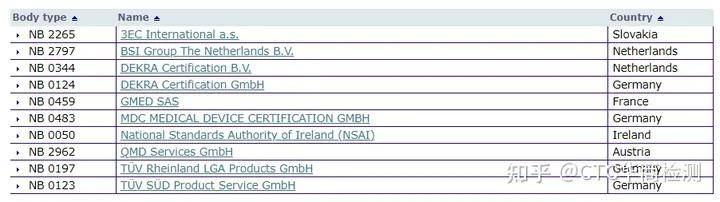
最主要变化点在于公告机构(Notified Body,NB)介入的增加,涉及产品有部分A类和所有的B、C、D类。在整个IVD领域,涉及公告机构介入的产品数量从IVDD监督管理体系下的10%~20%增加至80%~90%。以下是授权NB公告号详情信息。目前已经增至10家。
在IVDR的法规体系下,欧盟主管当局一个很重要的工作就是未来将要推出医疗器械数据库(Eudamed),该数据库涵盖从产品上市前审批到上市后监管中的很多重要信息。
IVDR中所提出的UDI由一个固定的产品识别码(Device Identifier,DI)和一个非固定的生产识别码(Production Identifier,PI)组成。生产企业在实施UDI的过程中,需要明确各产品的UDI代码及所包含的信息,并在产品上加贴UDI标贴,同时以电子形式存储UDI有关信息并在Eudamed系统上申报,用以增强产品的追溯以及上市后的管理。
IVDR法规中,首次要求每个制造商企业内,至少有一位法规负责人,负责处理与产品相关的监管、合规性相关工作,作为医疗器械公司和指定机构之间的联系。
另:分类属于“Other”的产品在满足IVDD指令要求后,通过Anne lI途径,在产品上使用CE标志,无需公告机构参与。
对于IVDD不需要公告机构参与,但是IVDR需要公告机构参与的IVD器械制造商,应尽快(在2022年5月26日之前)按照IVDD来完成DOC以获得缓冲期资格。返回搜狐,查看更加多

