初次注册、连续注册和答应事项改变注册请求10579项,同比添加15.6%
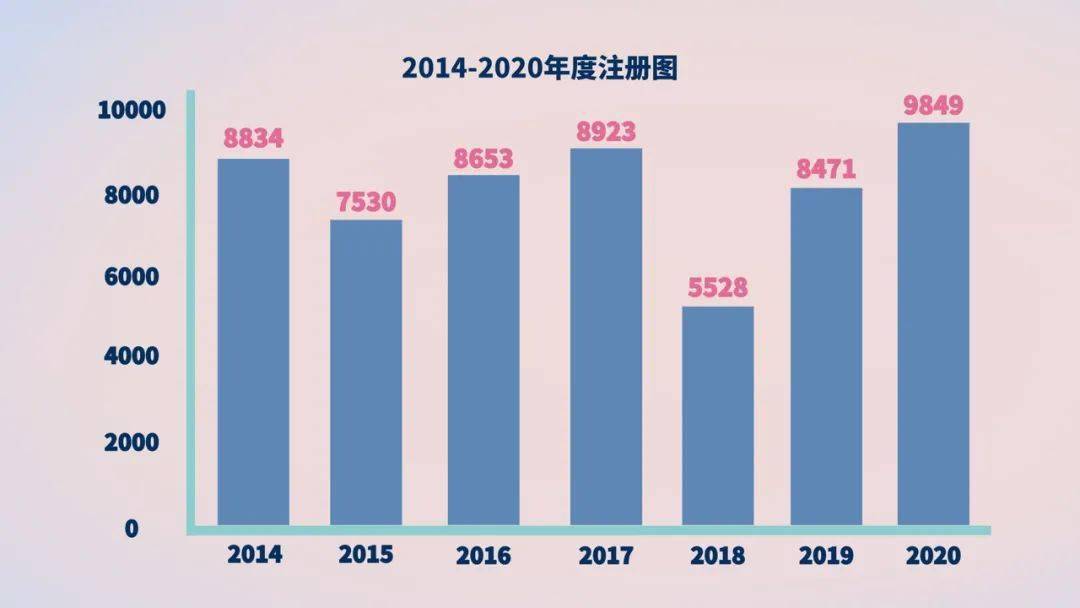
初次注册、连续注册和改变注册9849项,与2019年比较注册同意总数量添加16.3%。
2020年,国家药监局同意境内第三类医疗器械注册3603项,与2019年比较添加13.3%,进口医疗器械6246项,与2019年比较添加18%。
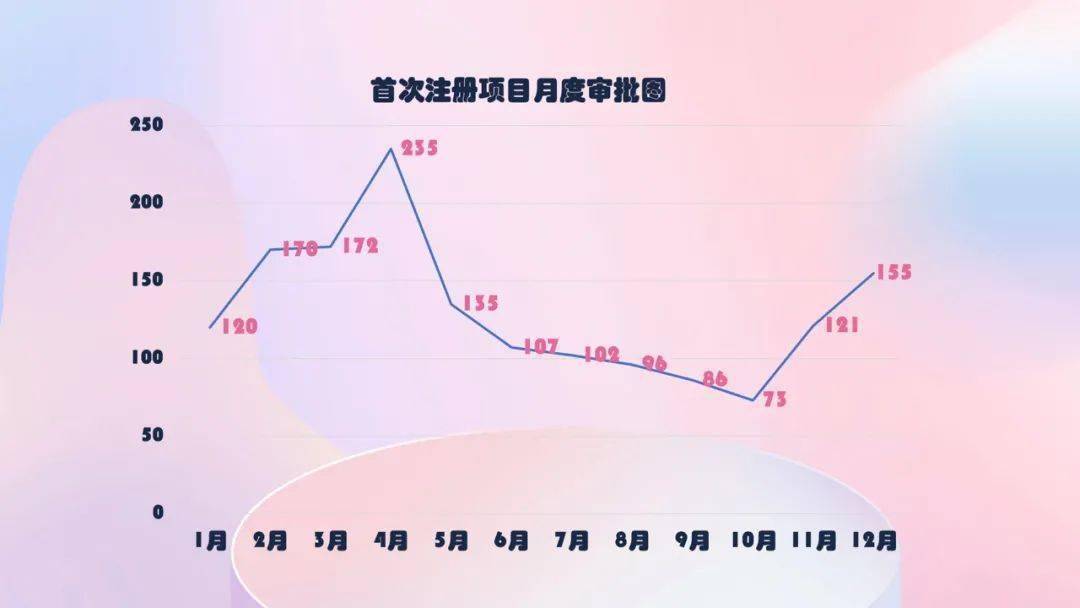
2020年,国家药监局共同意医疗器械初次注册1572项,月度批阅状况如下:
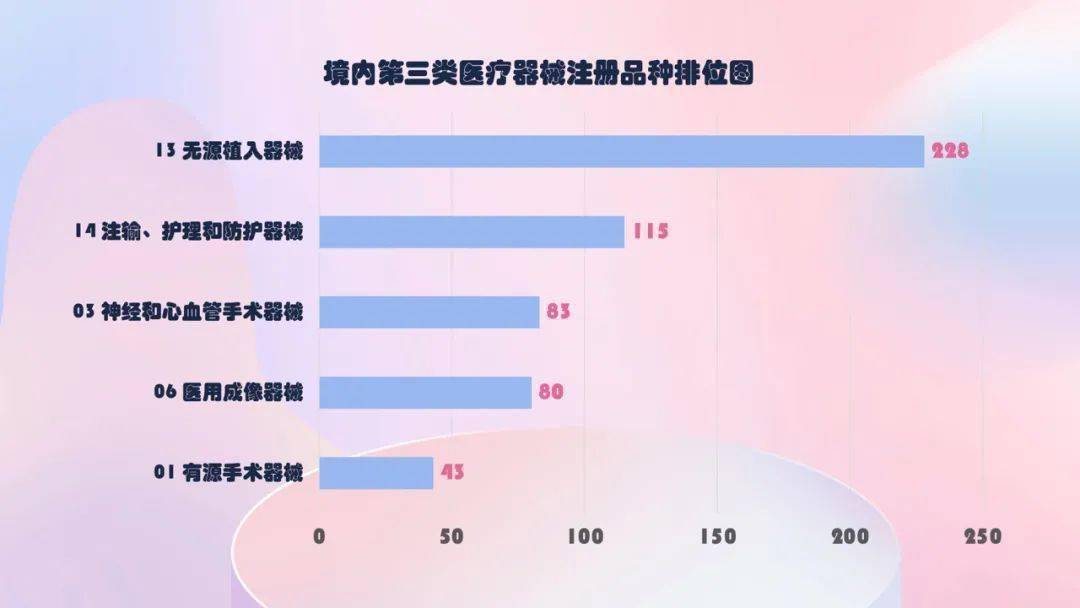
无源植入器械、注输、护理和防护器械、神经和心血管手术器械、医用成像器械和有源手术器械,与2019年相同。
其间医用成像器械从2019年的67项,添加到2020年的80项,添加约20%。
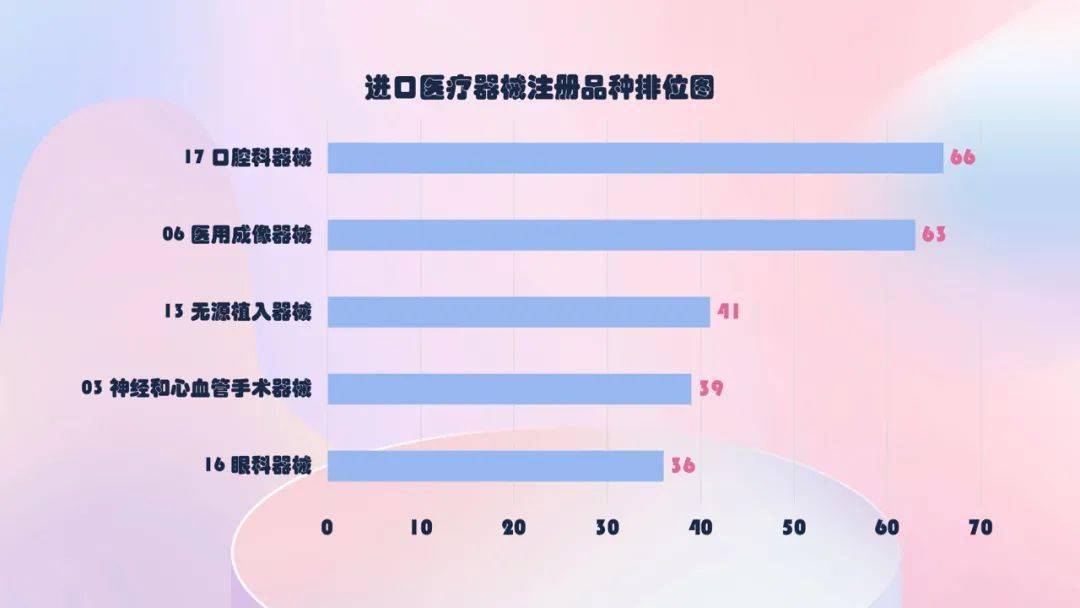
口腔科器械、医用成像器械、无源植入器械、神经和心血管手术器械、眼科器械。其间,口腔科器械从2019年的57项,添加到2020年的66项,添加约15.8%。
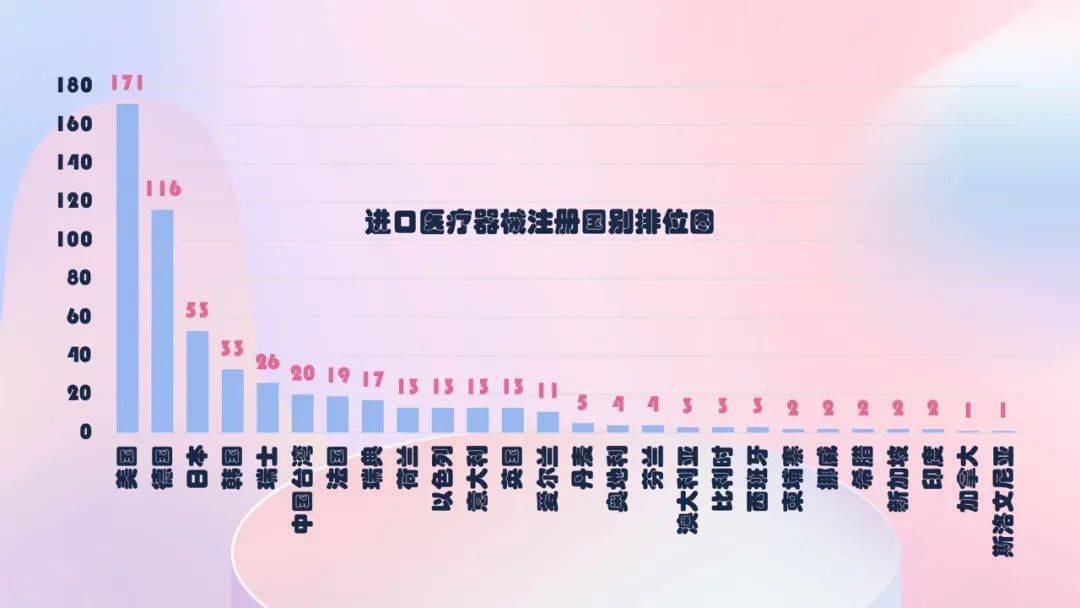
2020年,共有26个国家(区域)产品在我国获批上市,其间,美国、德国、日本、韩国、瑞士医疗器械在我国医疗器械进口产品初次注册数量排前5位,注册产品数量约占2020年进口产品初次注册总数量的72.3%,与2019年比较略有下降。
从进口医疗器械署理人散布看,共有17个省触及有本省企业作为进口医疗器械署理人,其间上海市署理人署理的进口初次医疗器械数量最多,占悉数进口医疗器械数量的64.9%。

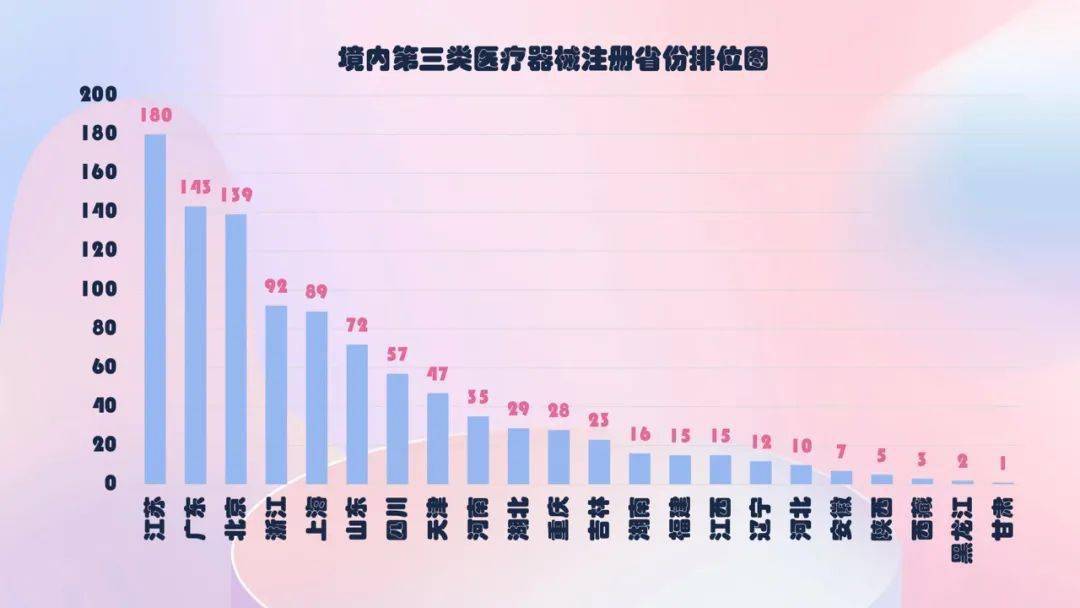
从2020年境内第三类医疗器械注册状况看,相关注册人大多散布在在沿海经济较兴旺省份。
其间,江苏、广东、北京、浙江、上海是境内第三类医疗器械初次注册数量排前五名的省份,占2020年境内第三类医疗器械初次注册数量的63%,与2019年比较略有下降。
2020年,国家药监局依照《立异医疗器械特别检查程序》,《医疗器械优先批阅程序》持续做好相关这类的产品的检查作业,共收到立异医疗器械特别批阅请求197项,54项获准进入特别检查程序,收到优先请求22项,12项获准优先批阅。
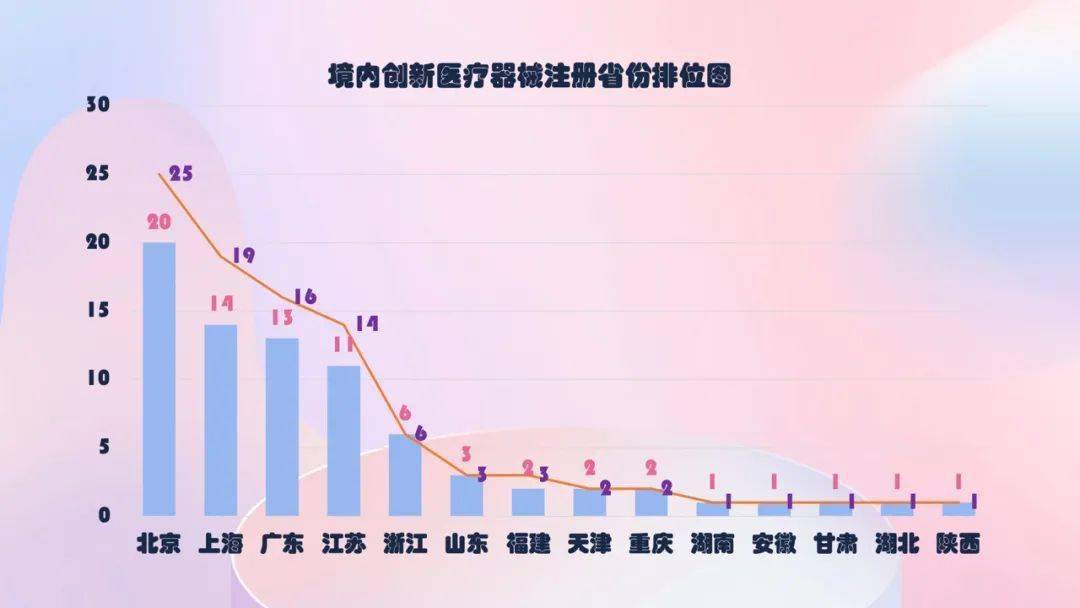
从2014年至2020年,国家药监局共同意99个立异医疗器械,其间,境内立异医疗器械触及14个省的78家企业,进口立异医疗器械触及2个国家的4个企业。
北京、上海、广东、江苏、浙江立异医疗器械获批产品数量和相应公司数最多,约占悉数已同意的99个立异医疗器械的81%。
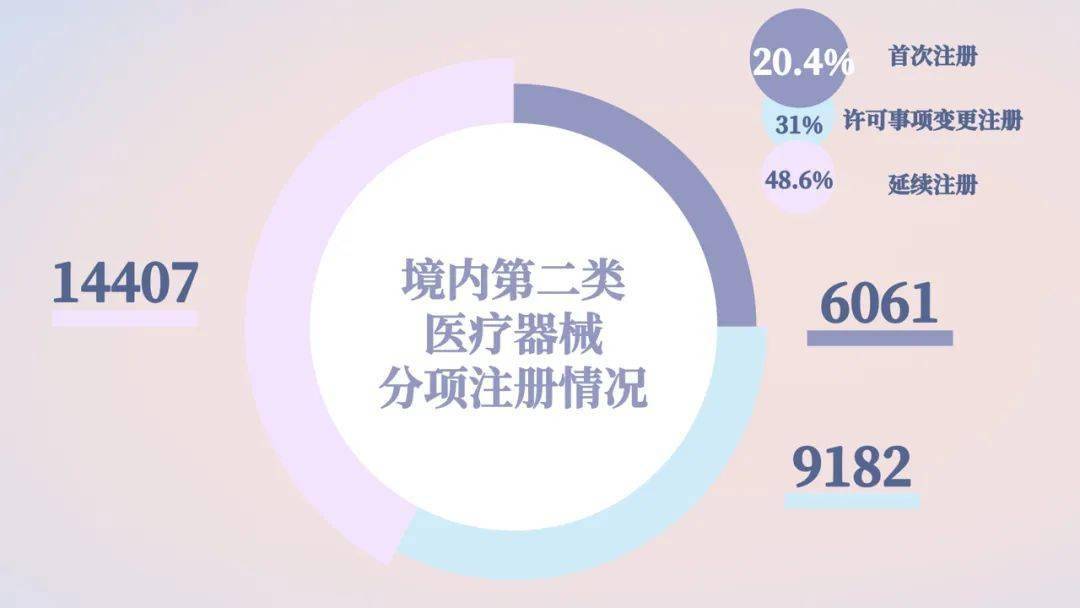
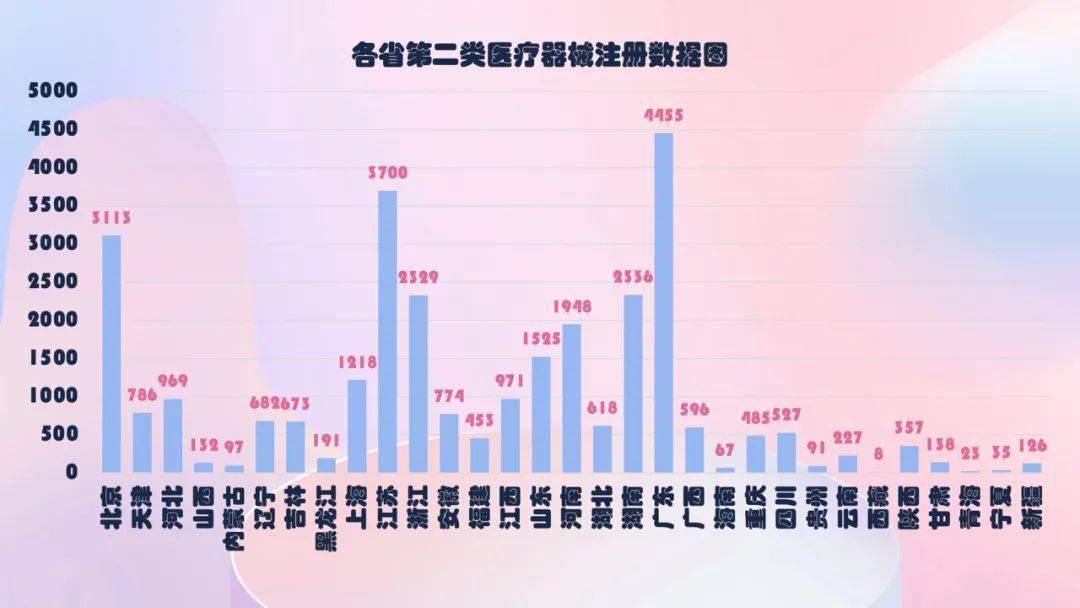
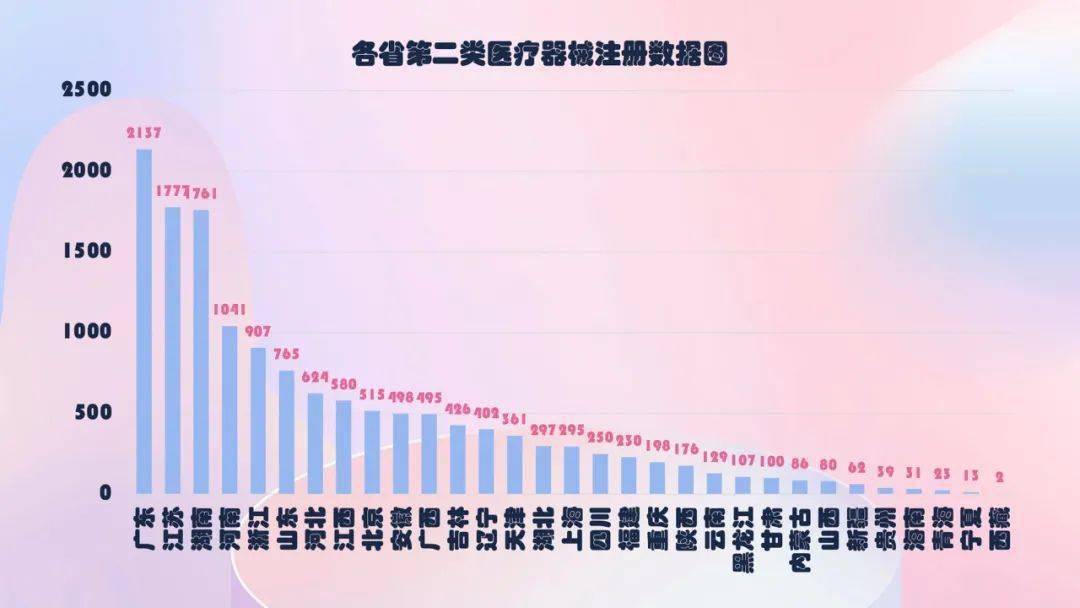
2020年,各省级药品监督管理部门共同意境内第二类医疗器械注册29650项,与2019年比较添加74.2%。
初次注册项目占悉数境内第二类医疗器械注册数量的48.6%。鉴于触及应急批阅注册项目4900项,去除应急批阅项目,实践与2019年比较添加45.4%。
连续注册9182项,与2019年比较添加28.4%,占悉数境内第二类医疗器械注册数量的31%;
答应事项改变注册6061项,与2019年比较添加65.9%,占悉数境内第二类医疗器械注册数量的20.4%。
从注册状况看,广东、江苏、北京、湖南、浙江、河南、山东、上海、江西、河北10省(直辖市)注册的境内第二类医疗器械数量较多。
2020年,国家药监局依责任共处理进口第一类医疗器械存案数量1844项,与2019年比较添加33.3%。
全国设区的市级药品监管部门依责任共处理境内第一类医疗器械存案数量34644项,与2019年比较添加106.8%。

